登录新浪财经APP 搜索【信披】查看更多考评等级七星策略
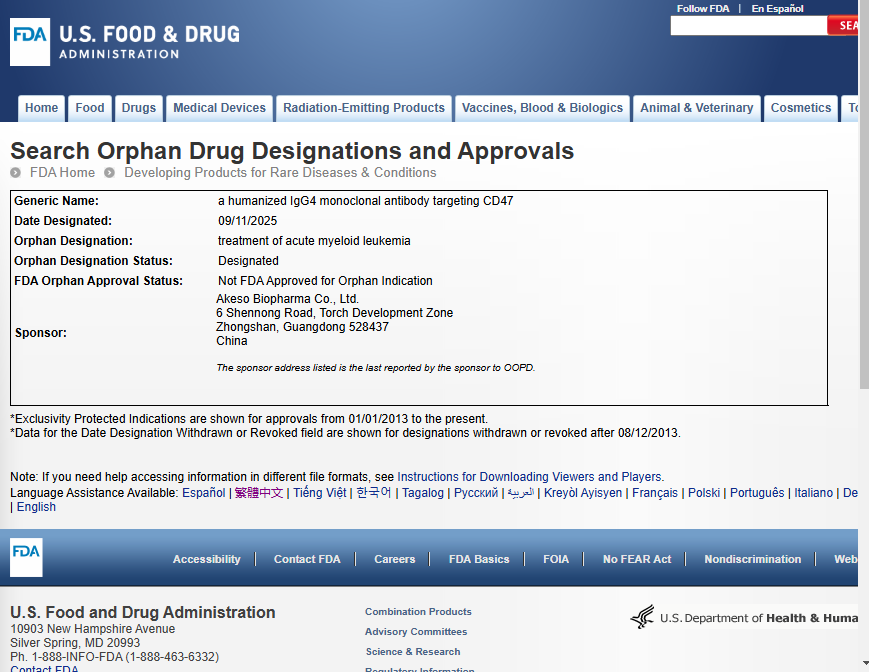
近日,美国食品药品监督管理局(FDA)授予了康方生物(9926.HK)自主研发的新一代抗CD47人源化IgG4单克隆抗体莱法利单抗(AK117)孤儿药资格认定(Orphan Drug Designation,ODD),适应症为急性髓系白血病(AML)。
孤儿药资格认定是FDA为鼓励针对罕见病治疗药物研发而设立的特殊激励政策。将有助于该药物在美国的后续研发及商业化开展等方面享受众多积极的政策支持,包括享有临床试验费用税收减免、免除NDA申请费用、获得研发资助,以及该适应症批准上市后可获得美国市场7年独占权等。获得该资格认定,是FDA对莱法利单抗临床价值潜力的认可和期许。
目前,康方生物围绕莱法利单抗在血液肿瘤和实体瘤领域的临床开发均处于国际领先阶段。除AML外,莱法利单抗联合阿扎胞苷治疗较高危骨髓增生异常综合征(HR-MDS)的随机、双盲、国际多中心Ⅱ期临床研究已完成患者入组。
与此同时,莱法利单抗是全球首个进入实体瘤注册性Ⅲ期临床阶段的CD47单抗。目前,其联合依沃西一线治疗PD-L1阳性头颈部鳞状细胞癌(HNSCC)及联合依沃西一线治疗胰腺癌的两项Ⅲ期临床试验正在高效推进中。

AML是一种异质性血液系统恶性肿瘤,以骨髓、外周血及髓外组织中髓系原始细胞异常克隆增殖为主要特征,是成人中最常见的急性白血病类型。根据美国国家综合癌症网络(NCCN)指南,AML的治疗策略取决于患者是否适合接受强化诱导化疗。而对于不适合强化疗的患者,目前仍缺乏有效治疗手段。
FDA目前已批准维奈克拉联合阿扎胞苷、地西他滨或低剂量阿糖胞苷方案,用于75岁及以上或因合并症无法接受强化诱导化疗的新诊断AML患者。然而,超过半数患者会在6-9个月内复发,中位总生存期仅一年左右,临床仍存在巨大未满足需求。

莱法利单抗是一种抗CD47人源化IgG4单克隆抗体,它可特异性结合肿瘤细胞表面表达的CD47,阻断其与SIRPα受体的相互作用,解除“别吃我”信号,增强巨噬细胞对肿瘤细胞的吞噬作用,从而抑制肿瘤生长。
值得注意的是,得益于独特的药物设计,莱法利单抗不诱导红细胞凝集,药物安全性和有效性均显著优于其他同靶点药物,疗效、安全性和用药便利性显著提高。
临床前研究显示七星策略,与阿扎胞苷或维奈克拉联用时,莱法利单抗可协同增强“吃我”信号(如钙网蛋白)的表达,从而更高效地激活吞噬免疫反应。因此,莱法利单抗联合阿扎胞苷与维奈克拉的方案,有望为不适合标准诱导化疗的AML患者提供更优治疗选择。
临床研究显示,莱法利单抗联合阿扎胞苷方案安全性良好,并在AML一线治疗中展现出鼓舞人心的疗效:在高达45 mg/kg每两周给药一次的剂量下仍耐受良好,各组之间未见显著安全性差异。目标剂量的完全缓解(CR)率达50.0%,复合完全缓解(cCR)率更高达55.0%。
基于该积极结果,为进一步提升疗效,康方生物正在开展一项Ⅱ期临床研究,评估莱法利单抗联合维奈克拉与阿扎胞苷方案,用于一线不适合强化疗的AML患者的安全性与有效性。
说明:本文作为康方生物的新闻发布,用于披露公司最新进展,并非产品推广广告,不构成康方生物的信息披露或投资建议。

关于莱法利
(AK117,CD47单抗)
莱法利单抗是康方生物自主研发的新一代人源化lgG4 单克隆抗体,可与肿瘤细胞上表达的CD47结合,阻断CD47与其受体SIRPα的相互作用,增强吞噬细胞对肿瘤细胞的吞噬活性,从而抑制肿瘤生长。
莱法利单抗目前正在全球同步推进实体瘤和血液瘤临床试验,莱法利单抗也是全球首个进入实体瘤注册性Ⅲ期临床阶段的CD47单抗。莱法利联合依沃西对比帕博利珠单抗一线治疗PD-L1阳性头颈鳞癌的III期临床研究,以及莱法利联合依沃西一线治疗胰腺癌的III期临床研究均在入组中。莱法利联合维奈克拉和阿扎胞苷一线治疗unfit AML的中国II期临床研究、莱法利治疗MDS的国际多中心II期临床研究均在入组中。此前,莱法利联合阿扎胞苷治疗血液瘤,莱法利单药或联合依沃西和卡度尼利治疗多种实体瘤的II期临床研究初步研究疗效数据优异,未观察到剂量限制性毒性事件,表现出优越的安全性。

关于康方生物
康方生物(9926.HK)是一家集研究、开发、生产及商业化全球首创或同类最佳创新生物新药于一体的领先企业。自2012年成立以来,公司始终以患者为中心,以临床价值为导向,打造了独有的端对端康方全方位新药研究开发平台,建立了以Tetrabody双特异性抗体开发技术、抗体偶联(ADC)技术、siRNA/mRNA技术及细胞治疗技术为核心的研发创新体系,国际化标准的GMP生产体系和运作模式先进的商业化体系,成为了在全球范围内具有竞争力的生物医药创新公司。
公司已开发了50个以上用于治疗肿瘤、自身免疫、炎症、代谢疾病等重大疾病的创新候选药物,24个候选药已进入临床(包括15个双抗/多抗/双抗ADC),7个新药已在商业化销售,3个新药3个适应症的上市申请处于审评审批阶段。
康方生物是全球迄今唯一拥有2个肿瘤免疫双抗新药的制药公司:
2022年6月,公司全球首创的PD-1/CTLA-4双抗卡度尼利获批上市,是全球首个获批的肿瘤免疫治疗双抗新药,也是中国第一个双特异性抗体新药。目前卡度尼利一线治疗胃癌、一线治疗宫颈癌和治疗复发/转移性宫颈癌的适应症已获批,10个注册性/III期临床正在开展。
2024年5月,公司全球首创的PD-1/VEGF双抗新药依沃西获批上市,用于EGFR-TKI治疗进展的局部晚期或转移性nsq-NSCLC,成为全球首个获批的“肿瘤免疫+抗血管生成”机制双抗新药。同期,依沃西在与全球“药王”帕博利珠单抗的随机、双盲、对照一线治疗PD-L1阳性NSCLC的“头对头”III期临床研究中获得显著阳性结果,依沃西可降低患者疾病进展/死亡风险达49%,依沃西成为全球首个在头对头III期临床研究中证明疗效显著优于“药王”帕博利珠单抗的药物。基于该研究结果,依沃西该项适应症于2025年4月获批上市,成为一线肺癌治疗新的标准治疗方案,为患者提供全新更优的“去化疗”选择。目前依沃西
有13项注册性/III期临床已开展,包括3项国际多中心注册性III期临床研究。
2024年12月,卡度尼利和依沃西均通过医保谈判被纳入国家新版医保目录。
国际市场开发是康方生物核心发展战略,继2015年开中国先河将自主研发的CTLA-4单抗权益许可给默沙东公司之后,2022年12月,公司再次创造中国纪录,以50亿美金+2位数百分比销售提成的方案,将依沃西部分海外权益许可给美国Summit公司,该合作创下了彼时中国新药对外许可的最高交易金额纪录。2025年2月,Summit 与美国辉瑞(Pfizer)公司达成临床试验合作,共同推进依沃西联合辉瑞多款抗体偶联药物(ADCs)在多种实体瘤中的联合治疗疗法。卡度尼利联合方案一线治疗转移性鼻咽癌和单药用以铂类为基础的化疗治疗失败的转移性鼻咽癌两项适应症于2025年4月获得美国食品药品监督管理局(FDA)批准上市。
2024年9月,公司自主研发的伊努西单抗(PCSK9)治疗高胆固醇血症两项适应症获批,成为非肿瘤领域的首个获批产品。2025年4月,公司独立自主研发的依若奇单抗(IL-12/IL-23“双靶向”单抗)获得批准上市,用于中重度斑块状银屑病成人患者的治疗。公司非肿瘤领域的产品协同效应和战略组合力进一步提升。
康方生物期望通过高效及突破性的研发创新七星策略,开发国际首创及同类药物最佳疗法的新药,为全球患者提供更优疾病解决方案,成为全球领先的生物制药企业。
 海量资讯、精准解读,尽在新浪财经APP
海量资讯、精准解读,尽在新浪财经APP
盈昌配资提示:文章来自网络,不代表本站观点。